技术文章

药品稳定性试验箱应用与2025版药典标准深度解析
药品稳定性试验箱作为制药行业质量控制的核心设备,其重要性随着2025版《中国药典》的实施而愈发凸显。本文将系统性地从设备应用、新规变化、测试方法和技术发展四个维度,全面剖析药品稳定性研究的最新要求与实践。
一、药品稳定性试验箱的核心功能与行业应用
1.1 精密控制系统构成技术基石
现代药品稳定性试验箱采用先进的PID(比例-积分-微分)控制算法,配合高灵敏度铂电阻温度传感器和电容式湿度传感器,能够实现±0.3℃的温度控制精度和±2%RH的湿度波动范围。这种控制水平对于获得可靠的稳定性数据至关重要,特别是对温度敏感的疫苗、生物制剂等特殊药品。
空气循环系统采用三维立体送风技术,通过计算流体动力学(CFD)优化的风道设计,确保箱内各点温湿度差异不超过±1℃和±3%RH。某国际制药企业的对比测试显示,与传统试验箱相比,采用立体送风技术的设备可使样品间差异降低42%,显著提高了数据的一致性。
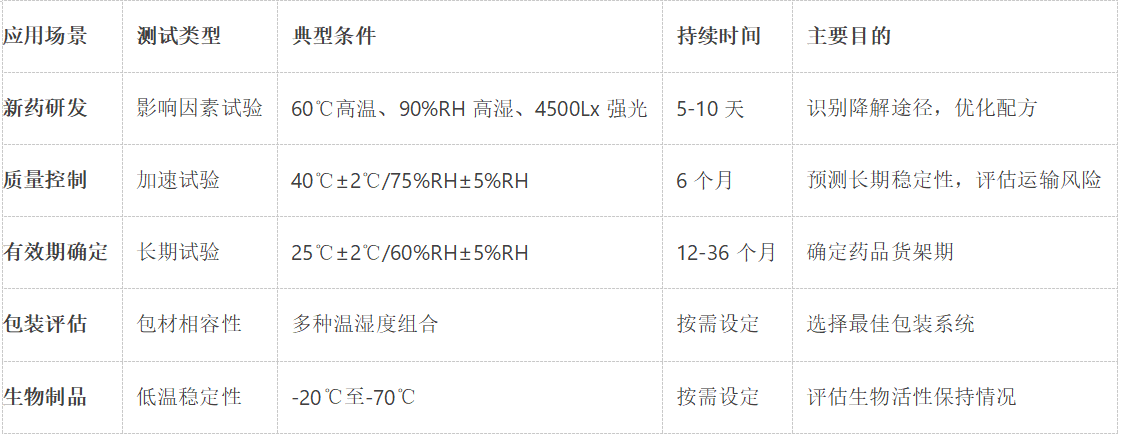
1.2 多功能应用覆盖药品全生命周期
在新药研发阶段,稳定性试验箱主要用于强制降解试验。根据ICH Q1A指导原则,典型的测试条件包括:
高温试验:60℃条件下持续10天
高湿试验:25℃/90%RH环境暴露10天
光照试验:4500Lx±500Lx照度下测试10天
某国内创新药企的案例显示,通过系统的强制降解试验,其研发中的抗肿瘤药物在早期就识别出了光敏感性问题,从而及时调整了包装方案,避免了后续开发风险。
商业化生产阶段,稳定性试验箱主要承担三项关键任务:
加速稳定性试验:40℃±2℃/75%RH±5%RH条件下进行6个月测试
长期稳定性试验:25℃±2℃/60%RH±5%RH条件下持续12-36个月
中间条件试验:30℃±2℃/65%RH±5%RH作为补充测试
二、2025版药典对稳定性试验的关键修订与应对策略
2.1 药包材测试体系的重大更新
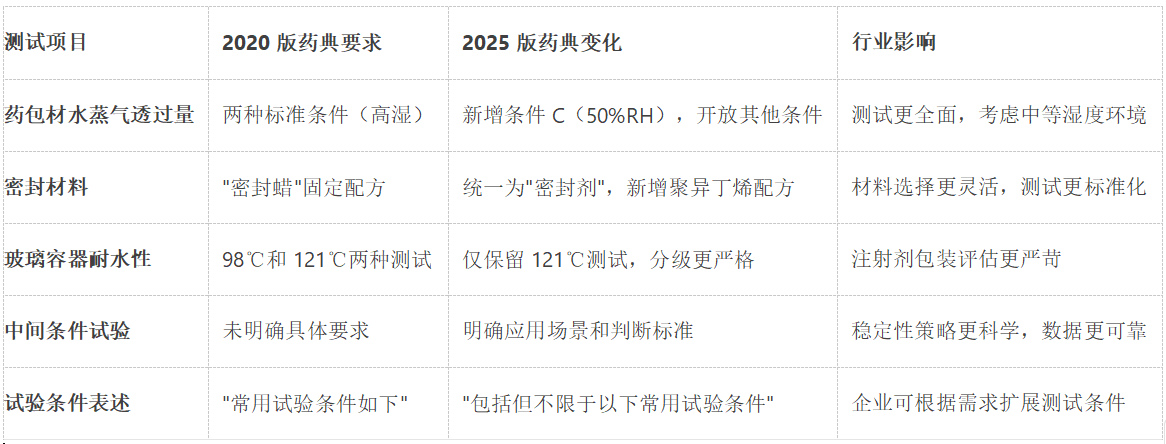
2025版药典对药包材水蒸气透过量测定法(通则4010)进行了全面修订,主要变化包括:
新增测试条件C:温度23℃±2℃,相对湿度50%±5%,填补了中等湿度测试的空白
扩展测试条件表述:将"常用试验条件如下"修改为"包括但不限于以下常用试验条件",为特殊气候条件测试提供了法规依据
干燥剂选择多样化:在保留无水氯化钙的基础上,新增硅胶、分子筛等选项,要求使用前必须进行有效活化
某跨国药包材企业的测试数据显示,在23℃/50%RH条件下,某些复合膜的透湿性能与40℃/90%RH条件下存在显著差异(平均差异达35%),凸显了新测试条件的实际价值。
2.2 注射剂包装标准显著提高
2025版药典对注射剂玻璃容器的耐水性测试做出重要调整:
取消98℃测试,仅保留121℃高压灭菌条件下的测试要求
严格分级标准,删除非药用相关的三级耐水性要求
新增表面耐水性测试,更全面评估玻璃容器性能
这些变化使中国标准与欧洲药典(EP)和美国药典(USP)进一步接轨。据国家药品包装材料检测中心统计,新标准实施后,国产中性玻璃的合格率预计将从92%降至87%,促使企业提升生产工艺。
2.3 中间条件试验的明确规范
2025版药典首次详细规定了中间条件试验(30℃±2℃/65%RH±5%RH)的应用场景:
当加速试验出现"显著变化"时需启动
明确"显著变化"判定标准:
含量与初始值相差≥5%
任何降解产物超出标准限度
pH值超出规定范围
溶出度不符合标准(12片中有1片超出限度)
某仿制药企业的实际案例显示,在加速试验3个月时发现含量下降4.8%,立即启动中间条件试验后证实该变化为分析方法变异所致,避免了不必要的产品报废。
三、差异化测试策略与有效期确定方法
3.1 分类测试策略的科学建立
化学药品的稳定性评估:
影响因素试验:60℃/75%RH/4500Lx条件下进行
重点考察项目:有关物质(特别关注降解产物)、含量、溶出度
包装选择:基于高湿测试结果确定防潮等级
某抗生素产品的稳定性数据显示,在铝塑泡罩包装下,高湿条件(90%RH)时的降解速率是铝箔复合膜包装的2.3倍,直接影响了最终包装决策。
生物制品的特殊要求:
储存条件:通常2-8℃,部分品种需要-20℃或-70℃
关键指标:生物活性、聚合物含量、可见异物
冻融试验:至少进行3次-20℃至25℃循环测试
某单抗药物的稳定性研究表明,经过3次冻融循环后,其聚集物含量从0.5%上升至1.8%,促使企业优化了冷链运输方案。
3.2 有效期的科学确定方法
药品有效期的确定需要综合多种数据:
长期试验数据:主要依据,通常覆盖拟定的有效期
加速试验数据:支持性证据,可用于外推
常规药品:6个月加速数据可支持24个月有效期
冷藏药品:外推不超过长期试验时间加6个月
统计分析方法:
采用线性回归分析降解趋势
计算95%单侧置信限与质量标准交点
考虑批次间变异(通常≥3批数据)
某降糖药片的稳定性分析案例显示,通过统计模型预测的有效期为32个月,最终保守确定为24个月,体现了科学性与风险控制的平衡。
四、技术创新与行业最佳实践
4.1 关键技术进步
温湿度控制技术:
自适应PID控制:根据负载变化自动调节参数
双制冷系统:确保连续运行可靠性
无线传感器网络:实时监测箱内多点环境参数
某品牌试验箱的测试数据显示,采用自适应PID控制后,温度波动从±0.5℃降低到±0.2℃,能耗同时降低15%。
数据管理系统:
符合21 CFR Part 11:完整审计追踪、电子签名
云端数据备份:防止数据丢失
智能预警系统:基于机器学习预测设备故障
4.2 验证与校准体系
完善的设备管理应包括:
IQ/OQ/PQ验证(3Q验证):
安装确认(IQ):验证设备安装符合规范
运行确认(OQ):测试各项功能正常运行
性能确认(PQ):验证实际负载下的温湿度性能
定期校准:
温度传感器:每6个月校准一次
湿度传感器:每12个月校准一次
使用NIST可溯源的标准器
某GMP认证企业的经验表明,实施严格的校准计划后,稳定性数据的异常率从3.2%降至0.7%。
4.3 持续改进趋势
行业正在向以下方向发展:
模块化设计:灵活配置温湿度范围、光照模块等
绿色节能:变频压缩机、热回收系统
智能化管理:远程监控、预测性维护
数据整合:与LIMS(实验室信息管理系统)无缝对接
2025版药典的实施将推动药品稳定性研究进入新阶段。制药企业需要全面理解法规变化,选择技术先进的试验设备,建立科学的测试方案,才能确保药品在全生命周期中的质量稳定。这不仅关系到企业的合规经营,更是对患者用药安全的重要保障。

 13917986725
13917986725